1-Teoría de Tectónicas de placas:
A)La propuso el metereólogo y geofísico alemán Alfred Wegener
.B) Él propuso que los continentes en el pasado geológico estuvieron unidos en un supercontinente de nombre Pangea, que posteriormente se habría disgregado por deriva continental.La tectónica de placas considera que la litósfera está dividida en varios grandes segmentos relativamente estables de roca rígida, denominados placas que se extienden por el globo como caparazones curvos sobre una esfera. Existen siete grandes placas.Por ser las placas parte de la litósfera, se extienden a profundidades de 100 a 200 km. Cada placa se desliza horizontalmente relativa a la vecina sobre la roca más blanda inmediatamente por debajo. Más del setenta por ciento del área de las placas cubre los grandes océanos como el Pacífico, el Atlántico y el Océano Indico.
C) Panguea fue el supercontinente que existió al final de la era Palezoica y comienzos de la era Mesozoica que agrupaba la mayor parte de las tierras emergidas del planeta. Se formó por el movimientos de las placas téctonicas que hace unos 300 millones de años unió todos los continenetes anteriores en uno solo; posteriormente, hace unos 200 millones de años, comenzó a fracturarse y disgregarse hasta alcanzar la situación actual de los continentes, en un proceso que aún continúa. Este nombre aparentemente fue usado por primera vez por el alemán Alfred Wegener principal autor de la teoría de la deriva continental.
D) 
Alfred Wegener
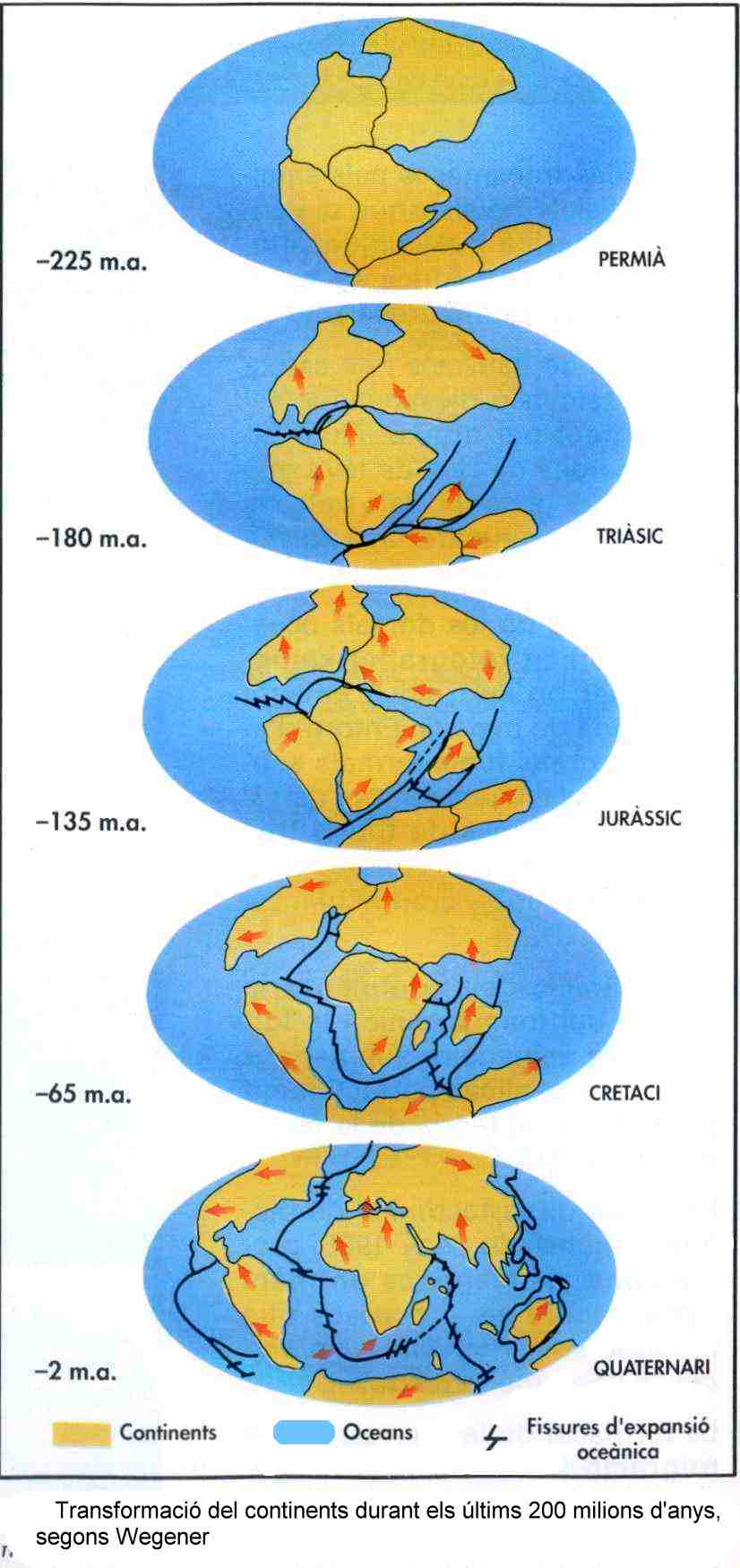
Pangea
2- Placas litosféricas

A)
La
placa Sudamericana es una placa tectónica que abarca dicho subcontinente y la porción del océano Atlántico Sur comprendida entre la costa sudamericana y la dorsal mesoatlántica, esta placa abarca unos 9 millones de kilómetros cuadrados.
B)
La
Placa Africana es una placa tectónica continental que cubre el continente africano y que se extiende hacia el oeste hasta la dorsal mesoatlántica.
C)
La
placa arábiga o árabe es una placa tectónica que ocupa la península arábiga y parte del Oriente Próximo. En ciertas zonas de Turquía, donde se encuentra el límite entre esta placa y la euroasiática, se producen frecuentes terremotos. En tiempos recientes (a escala geológica) la separación de esta placa y la placa africana creó un nuevo espacio que sería rellenado por el mar Rojo.
D)
La
Placa Euroasiática es una placa tectónica continental que abarca Eurasia, exceptuando el subcontinente indio, Arabe y parte de Siberia al Este de la Cordillera Verkhoyansk. También incluye la parte oriental del océano Atlántico Norte hasta la dorsal mesoatlántica, totalizando un territorio de unos 67.800.000 km².
E)
La
placa Norteamericana es aquella placa tectónica continental que cubre América del Norte (incluyendo a Groenlandia), los archipiélagos de Cuba y las Bahamas en el mar Caribe, la parte occidental del océano Atlántico Norte (hasta la dorsal Mesoatlántica), una parte del océano Glacial Ártico y el territorio siberiano al este de la cordillera Verjoyansk.
F)
La
Placa indoaustraliana es una placa tectónica que se extiende desde la frontera de la India con China y Nepal, abarcando el Subcontinente indio, este del océano Índico, Australia, Melanesia y extendiéndose hasta Nueva Zelanda.
Se subdivide en dos placas que se fusionaron hace 50-55 millones de
años, y cuyos límites mantienen una baja actividad tectónica: la placa australiana y la placa india.
G)
La
placa Antártica es una placa tectónica que cubre la Antártida y que se extiende hacia fuera, debajo de los océanos circundantes, abarcando casi 17 millones de kilómetros cuadrados.
H)
La
placa de Nazca es una placa tectónica oceánica que se encuentra en el océano Pacífico oriental, frente a la costa occidental de América del Sur, más específicamente al frente a la costa norte y centro de Chile y la totalidad del litoral de Perú, Ecuador y Colombia.
El borde oriental de la placa se encuentra dentro de en una zona de subducción bajo la placa Sudamericana, lo que ha dado origen a la Cordillera de los Andes y a la fosa peruano-chilena. El límite austral de la placa de Nazca con respecto a la placa Antártica está formado por la dorsal de Chile, y el límite occidental con la placa del Pacífico por la dorsal del Pacífico Oriental. En el norte el límite de la placa de Nazca con la placa de Cocos está formado en gran parte por la dorsal de Galápagos.
I)
La
placa del Pacífico es una placa que abarca la mayor parte del
Océano Pacífico. Es una de las más grandes del planeta. Una de sus
características principales está constituida por puntos calientes subyacentes que originaron las islas Hawaii y otros numerosos archipiélagos volcánicos.





 Alfred Wegener
Alfred Wegener